Prezentare succintă: izomeria geometrică, compuși ciclici, legături duble.
Este un tip de izomerie determinat de poziția substituenților față de planul unei legături π sau față de planul unui ciclu saturat sau nesaturat.
Izomeria geometrică a compușilor ciclici.
Cazul cel mai simplu de izomerie geometrică la compușii ciclici este cel al compușilor cu doi substituenți în poziții diferite ale ciclului. Atât în cazul compușilor cu substituenți identici, cât și al celor cu substituenți diferiți, izomerii se numesc cis și trans, în funcție de poziția substituenților față de planul ciclului:
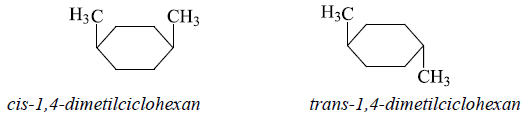
Izomeria cis-trans apare în seria alchenelor din cauza că rotirea liberă în jurul dublei legături (σπ) nu este posibilă.
Pentru cazurile simple (câte doi substituenţi identici la fiecare atom de carbon din dubla legătură), specificarea configuraţiei se face după regula:
• cis este izomerul în care substituenţii sunt de aceeaşi parte a legăturii duble;
• trans – pentru substituenţii de părţi opuse.
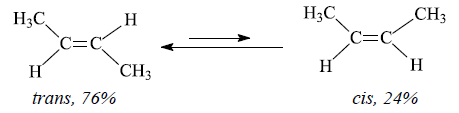
De exemplu, 2-butena există într-o formă cis, cu ambii radicali metil de aceeași parte a planului legăturii duble, și într-o formă trans, în care radicalii
metil sunt situați de o parte și de alta a planului legăturii duble. Cei doi izomeri sunt stabili, au proprietăți fizice caracteristice și pot fi transformați
unul în celălalt numai la temperaturi ridicate. În prezența unor acizi puternici se stabilește un echilibru între cei doi izomeri:
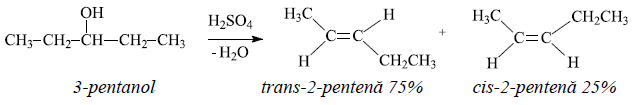
Izomerul trans are o stabilitate mai mare, demonstrată de stereoselectivitatea formării alchenelor la deshidratarea alcoolilor:
Diastereoizomerii cis-trans vor avea proprietăţi fizice diferite: puncte de topire, puncte de fierbere, densitate, solubilitate şi eventual rotaţia
specifi că. Pot fi separaţi prin metode fi zice obişnuite (recristalizare, distilare, cromatografie).
Diastereoizomerii au şi unele proprietăţi chimice diferite, mai ales cele ce depind de poziţia reciprocă a substituenţilor din cei doi izomeri. De
exemplu, cei doi izomeri ai acidului butendioic – acidul maleic și acidul fumaric
– au constantele de aciditate diferite, dar se comportă diferit și la
încălzire peste punctul de topire:
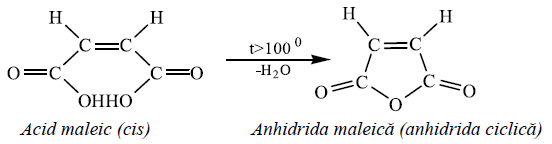
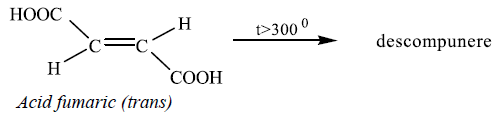
Folosirea simbolurilor cis-trans devine dificilă pentru moleculele cu substituenți diferiți la cei doi atomi de carbon legați prin legătura dublă.
De aceea IUPAC a recomandat raportarea izomerilor la poziția relativă a substituentului după regula standard de succesiune Cahn-Ingold-Prelog (CIP), regula E-Z.
Pentru aplicarea regulii CIP se utilizează regula de succesiune a substituenţilor, stabilindu-se prioritatea substituenţilor pentru fiecare pereche legată de cei doi atomi de carbon (substituenţii vor avea astfel prioritatea 1 sau 2 la fiecare atom de carbon).
Principalele reguli de stabilire a superiorității substituenților sunt:
– Se iau în considerare numerele atomice ale atomilor direct legați de centrul chiralic. Numărul atomic superior asigură prioritatea:
I > Br > Cl > S > F > O > N > C > H.
– Dacă primii atomi sunt identici, prioritatea se stabilește în funcție de numerele atomice ale atomilor din poziția a doua sau din pozițiile următoare:
CH2-CH3 > CH3 (CH2-H) sau CH2-Cl > CH2-H.
– Legăturile multiple au prioritate față de legăturile simple dintre atomi de același fel:
CH=CH2 > CH2=CH3; CH=O > CH2-OH.
– Catenele ramificate au prioritate față de cele liniare:
CH(CH3)2 > CH2-CH2-CH3.
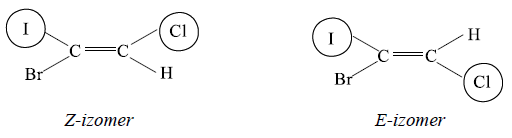
Dacă substituenţii cu prioritatea 1 (cea mai mare) de la cei doi atomi de carbon sunt de aceeaşi parte (adică în cis), configuraţia este notată cu Z, iar
dacă aceşti substituenţi sunt de părţi opuse, confi guraţia se notează cu E. Astfel se notează confi guraţiile pentru fi ecare legătură dublă din moleculă.
De exemplu:
<